Стала немного ясней взаимосвязь между тау-белком и бета-амилоидом
|
Болезнь Альцгеймера характеризуется двумя, на первый взгляд, абсолютно не связанными друг с другом вещами: во-первых, в нейронах накапливаются нейрофибриллярные клубки тау-белка, во-вторых, на поверхности нейронов откладываются амилоидные бляшки (см. Amyloid). Более или менее изучено, какую роль в патогенезе болезни играет каждый из этих процессов по отдельности — но вот о том, какова связь между ними, известно гораздо меньше. Группа американских ученых смогла немного прояснить этот вопрос.
Патогенез болезни Альцгеймера уже был довольно подробно описан на «Элементах» (см. Нейрофибриллярные клубки при болезни Альцгеймера — не убийцы, а защитники клеток?, «Элементы», 15.05.2010; Появилась новая мишень для борьбы с болезнью Альцгеймера, «Элементы», 17.09.2010). В этом патогенезе удивительно то, что он как будто состоит из двух несвязанных частей — нейрофибриллярные клубки и амилоидные бляшки возникают, вроде бы, совершенно независимо друг от друга. Но если бы болезнь развивалась лишь при «случайной встрече» этих двух патологических процессов, она бы, наверное, была распространена куда меньше. Иными словами, между возникновением клубков и бляшек (то есть между тау и бета-амилоидом) должна быть какая-то взаимосвязь.
Есть некоторые работы, в которых эта взаимосвязь показана — правда, можно сказать, только пунктирной линией. Например, у трансгенных мышей с повышенным уровнем бета-амилоида в мозге наблюдаются неврологические нарушения — а понижение эндогенного уровня тау-белка предотвращает развитие этих нарушений. Но вот как конкретно всё это происходит, чем в данном случае занимается амилоид, почему на его деятельность влияет уровень тау — это пока совершенная загадка.
Группа калифорнийских ученых из Стэнфордского и Калифорнийского (Окленд) университетов и Гладстонского института неврологических болезней (Сан-Франциско) предположила, что дело здесь в нарушении аксонного транспорта. На это указывает многое: при болезни Альцгеймера нарушается внутринейронное распределение некоторых перевозимых с этим транспортом грузов; тау-белок ассоциирован с микротрубочками (они работают «рельсами», по которым передвигается груз); к тому же показано, что бета-амилоид нарушает этот транспорт.
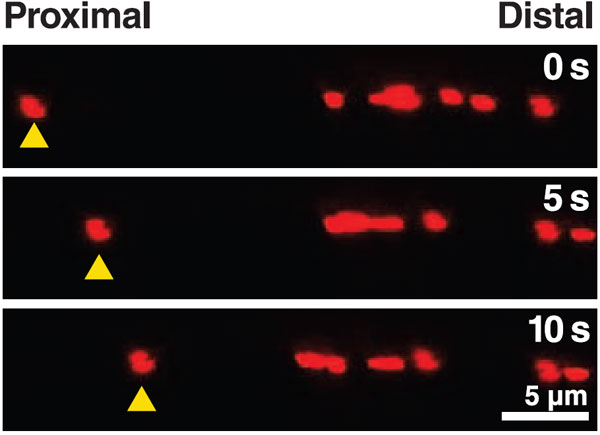
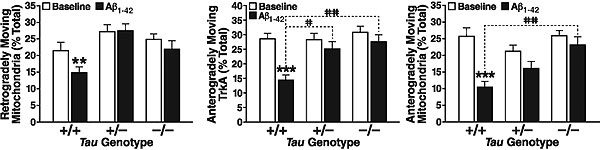
Теперь предстояло проверить выдвинутое предположение. Работа проводилась на культурах нейронов, нокаутных по тау-белку полностью или частично (Tau–/– или Tau+/–). Для контроля были взяты нейроны дикого типа (Tau+/+). Исследовался транспорт двух грузов — митохондрий и TrkA-рецепторов.
Выяснилось, что прибавление бета-амилоида быстро уменьшает подвижность грузов (вычисляемую как отношение движущихся грузов к грузам вообще) у нейронов дикого типа. В то же время, транспорт в тау-нокаутных нейронах от амилоида практически не страдает.
|
Амилоид устраивает «транспортный коллапс» по сложному механизму, запуская сразу несколько каскадов реакций. Пока нельзя сказать, как именно влияет на этот механизм тау — сам ли или через цепочку посредников, на одну ли реакцию или на несколько; или, может, вообще не на эти реакции, а на другие, еще не изученные. Всё это только предстоит узнать в дальнейших исследованиях. К тому же, результаты, полученные на нокаутах, могут оказаться некорректными — кто знает, какие изменения вызвало в клетках отсутствие тау-белка в течение всей их жизни? Поэтому было бы неплохо провести аналогичные эксперименты, но уже не с нокаутами, а нокдаунами — то есть с клетками, в которых тау был «выключен» на короткое время. Однако полученные результаты хоть немного проясняют таинственную связь между бета-амилоидом и тау-белком и показывают путь, по которому стоит двигаться, чтобы изучить ее подробнее.
Источник: Keith A. Vossel, Kai Zhang, Jens Brodbeck, Aaron C. Daub, Punita Sharma, Steven Finkbeiner, Bianxiao Cui, Lennart Mucke. Tau Reduction Prevents A?-Induced Defects in Axonal Transport // Science. 8 October 2010. V. 330. P. 198.