Ученые прояснили механизм формирования новых синапсов у больных склерозом мышей
|
Американские ученые исследовали роль регуляторной микро-РНК в развитии одной из разновидностей склероза. Они показали, что присутствие особой микро-РНК в высоких дозах способствует формированию новых контактов между мышечными и нервными волокнами. Регуляторный каскад, включающий эту микро-РНК, действует единообразно и у здоровых мышей при повреждении нервов, и у мышей, больных склерозом. Эта микро-РНК является весьма перспективным средством для замедления развития болезни.
Биохимики и генетики продолжают искать новые средства для лечения болезней человека, используя для своих исследований трансгенных животных. На животных с измененными или отключенными генами можно изучать развитие различных болезней и методы исправления биохимических неполадок. Именно такую работу и провела группа американских ученых из Гарвардского университета и Юго-Западного медицинского центра Техасского университета (Даллас). Перед ними стояла задача найти вещества, задействованные в развитии одной из смертельных болезней человека — латерального амиотрофического склероза, — и определить возможные способы ее лечения.
Эта болезнь вызывает отмирание моторных нейронов как в коре, так и в продолговатом мозге. В результате наступает денервация мышц: они постепенно перестают работать и атрофируются. Новые нервные окончания в мышечные клетки не прорастают, то есть не образуется новых нервно-мышечных контактов. Чаще всего больной погибает от удушья — прекращаются дыхательные движения. Причины болезни неизвестны. В 90-е годы прошлого века было показано, что в 20% семейных случаев этой болезни регистрируется точечная мутация гена супероксиддисмутазы (SOD1; эта точечная мутация обозначается G93A-SOD1, то есть глицин в 93-й позиции заменен аланином). Какие нарушения вызывает мутантная SOD1, пока непонятно. Но ученые создали мышей с такой же мутацией, и у этих мутантных мышей симптоматика заболевания схожа с человеческой. Так что теперь имеется хороший модельный объект для изучения этой болезни.
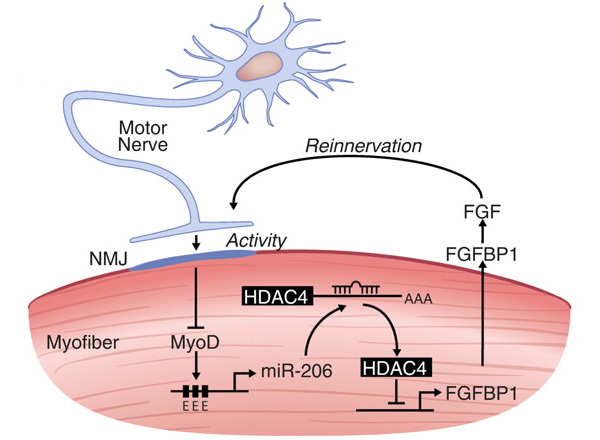
Именно таких мышей и использовали в экспериментах. Была измерена экспрессия микро-РНК в скелетных мышцах задних конечностей модельных (мутантных) и нормальных мышей. Только одна из 320 выделенных микро-РНК оказалась представлена сверхвысокой дозой у больных мышей — это так называемая микро-РНК-206. До начала проявления симптомов болезни количество микро-РНК-206 у нормальных и модельных мышей было сходным. То есть сверхэкспрессия микро-РНК-206 связана с наступлением болезни.
Для выяснения специфики работы микро-РНК-206 ученые вырастили мышей, у которых отсутствовала микро-РНК-206; ту же мутацию добавили и к линии трансгенных G93A-SOD1. У нормальных мышей без микро-РНК-206 никаких отклонений ни в анатомии, ни в поведении не было. А вот трансгены G93A-SOD1 без микро-РНК-206 показали очень быстрое развитие симптомов заболевания и более высокую смертность по сравнению с обычными трансгенами. Получается, что присутствие микро-РНК-206 в высоких дозах тормозит развитие заболевания.
Если у здоровых мышей перерезать нерв, ведущий к мышце, то, как выяснилось, в денервированной мышце резко возрастает количество микро-РНК-206. Значит, экспрессия микро-РНК-206 в мышцах резко активизируется в ответ на денервацию любой природы, будь то болезнь или повреждение нерва. Но важно понимать, что микро-РНК-206 экспрессируется в мышцах, а экспрессия активируется при недостатке иннервации. Из этого следует, рассудили ученые, что микро-РНК-206 участвует в формировании нервно-мышечных контактов, в том числе синапсов. Это предположение подтвердилось дополнительными экспериментами. При перерезании нерва у обычных мышей с отсутствующей микро-РНК-206 формирование новых синапсов в мышцах задерживалось примерно на 2–3 недели по сравнению с нормой.
В ходе чрезвычайно кропотливых и точных биохимических исследований удалось восстановить регуляторный каскад, в который встроена микро-РНК-206. В результате включения этого каскада происходит локальная (то есть только на микроуровне, а не на уровне всего организма) регенерация нервно-мышечных контактов.
|
Выработка микро-РНК-206 больным организмом — это попытка, хотя в конечном итоге и неудачная, восстановить иннервацию мышц. Однако работа этого каскада демонстрирует, что в организме имеется еще неизвестный набор возможностей для выздоровления даже в случаях тяжелых заболеваний.
Источник: Andrew H. Williams, Gregorio Valdez, Viviana Moresi, Xiaoxia Qi, John McAnally, Jeffrey L. Elliott, Rhonda Bassel-Duby, Joshua R. Sanes, Eric N. Olson. MicroRNA-206 Delays ALS Progression and Promotes Regeneration of Neuromuscular Synapses in Mice // Science. 2009. V. 326. P. 1494–1495.
Елена Наймарк